CARBOHIDRATOS
SINTESIS
Los carbohidratos o hidratos de carbono están formados por carbono (C), hidrógeno (H) y oxígeno (O) con la formula general (CH2O)n. Los carbohidratos incluyen azúcares, almidones, celulosa, y muchos otros compuestos que se encuentran en los organismos vivientes.
Los carbohidratos son los principales combustibles celulares y depositos de combustibles.
Su clasificación es:
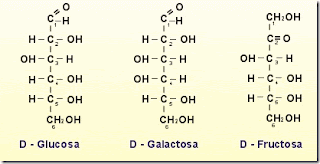
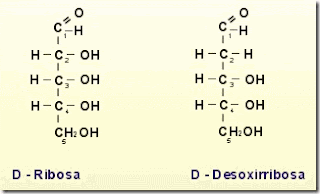
Monosacáridos: Son los más simples, se clasifican de acuerdo al número de carbonos que tenga la molecula, los más pequeños contienen 3 carbonos triosas, 4 carbonos tetrosas, 5 carbonos pentosas, 6 carbonos hexosas.
Disacáridos: Estan formados por dos monosacaridos, a través de un enlace glucosidico.
•Maltosa: 1 glucosa+ 1 glucosa
•Lactosa: 1 galactosa+ 1 glucosa
•Sacarosa: 1 glucosa+ 1 fructosa
Polisacáridos: Solo contienen glucosa.
•Almidón, es producido por las plantas, existen dos tipos; Amilosa y amilopectina.
•Glucógeno.
•Celulosa.
Bibliografía: Cuaderno de Biologia de la célula 2010-2; http://biologia.laguia2000.com/bioquimica/monosacridos
Los hidratos de carbono son fuente de energía, por lo tanto considerados alimentos energéticos y son importantes porque constituyen la mitad de una dieta balanceada. Son nutrientes que cumplen la función de combustible para el cuerpo. Al incrementar el esfuerzo físico sobreviene la sensación de cansancio, en este momento , los alimentos aportan la dosis de energía requerida siendo los principales aquellos que contienen hidratos de carbono como papas y pastas. Alimento esencial en la dieta de todo deportista.
Al ser la principal fuente de energía, son parte esencial de toda dieta. Surgiendo a partir de sustancias químicas, son moléculas simples llamadas sacáridos que se combinan produciendo 2 tipos de hidratos de carbono: azúcares y almidones.
Los azúcares son carbohidratos simples con 1 o 2 moléculas de sacáridos ligados llamados monosacáridos o disacáridos con sabor dulce y de rápida absorción. Los azúcares comunes son la sacarosa, azúcar de caña de azúcar que se encuentra en la leche y la fructosa, que se encuentra en las frutas.
Los almidones son carbohidratos complejos formados por 10 moléculas de sacáridos de absorción más lenta, son la fuente de energía más importante. Se encuentran en vegetales, frutas, féculas, pastas, arroz, maíz y avena.
Los alimentos ricos en carbohidratos son los cereales:
 Arroz y avena; hortalizas, papa y batata, derivados de granos: pastas, pan y frutas: banana, pera, manzana. Deportistas ya sean amateurs o profesionales deben consumir antes de un partido o carrera hidratos de carbono mediante un plato de fideos y si se trata de una maratón o una competencia la ingesta de un plato de fideos será durante los dos días o tres días anteriores.
Arroz y avena; hortalizas, papa y batata, derivados de granos: pastas, pan y frutas: banana, pera, manzana. Deportistas ya sean amateurs o profesionales deben consumir antes de un partido o carrera hidratos de carbono mediante un plato de fideos y si se trata de una maratón o una competencia la ingesta de un plato de fideos será durante los dos días o tres días anteriores.Las grasas son otras fuentes de energía, siendo de gran importancia porque proveen energía combinada creando químicos como las hormonas, aunque sus carbohidratos también son oxígeno, carbono e hidrógeno y se diferencia en proporciones funcionando como depósito de energía.
Son importantes de acuerdo al tipo de ácidos grasos,. Se clasifican en grasas saturadas e insaturadas y éstas se dividen en monoinsaturadas y poliinsaturadas.Las saturadas sólidas son de origen animal y son también las que aumentan el colesterol. Las insaturadas son por lo general líquidas, de origen vegetal y no tapan las arterias. El organismo, al recibirlas las transforma en ácidos grasos y en glicerol penetrando en el intestino para combinarse y componer los triglicéridos que se ligan a las proteínas y al colesterol para ser transportados por el flujo sanguíneo al cuerpo.
Bibliografia: http://www.comidasanaynuritiva.com/2010/05/los-alimentos-energeticos/